全民公众讯 据国家药品监督管理局网站消息,国家药监局发布《国家药监局关于57批次药品不符合规定的通告》。其中,经甘肃省药品检验研究院检验,标示为北京春风一方制药有限公司、山东宏济堂医药有限公司中药厂、新疆本草堂中药饮片有限公司、安徽亳源药业饮片有限公司生产的4批次血竭不符合规定,不符合规定项目包括鉴别、醇不溶物;其中标示为安徽亳源药业饮片有限公司生产的1批次血竭同时检查出808猩红、松香酸。
国家药监局关于57批次药品不符合规定的通告(2019年 第85号)全文如下:
国家药监局关于57批次药品不符合规定的通告(2019年 第85号)
经苏州市药品检验检测研究中心等11家药品检验机构检验,标示为康普药业股份有限公司等40家企业生产的57批次药品不符合规定。现将相关情况通告如下:
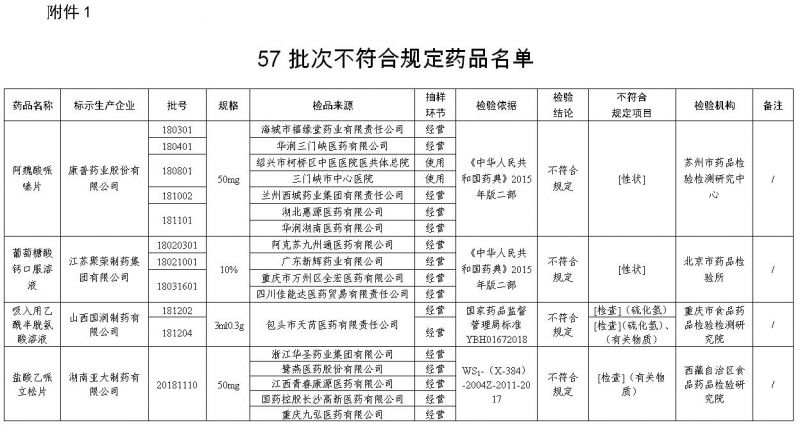
一、经苏州市药品检验检测研究中心检验,标示为康普药业股份有限公司生产的5批次阿魏酸哌嗪片不符合规定,不符合规定项目为性状。
经北京市药品检验所检验,标示为江苏聚荣制药集团有限公司生产的3批次葡萄糖酸钙口服溶液不符合规定,不符合规定项目为性状。
经重庆市食品药品检验检测研究院检验,标示为山西国润制药有限公司生产的2批次吸入用乙酰半胱氨酸溶液不符合规定,不符合规定项目包括硫化氢、有关物质。
经西藏自治区食品药品检验研究院检验,标示为湖南亚大制药有限公司生产的1批次盐酸乙哌立松片不符合规定,不符合规定项目为有关物质。
经新疆维吾尔自治区食品药品检验所检验,标示为广西梧州三箭制药有限公司生产的1批次感冒止咳糖浆不符合规定,不符合规定项目为含量测定。
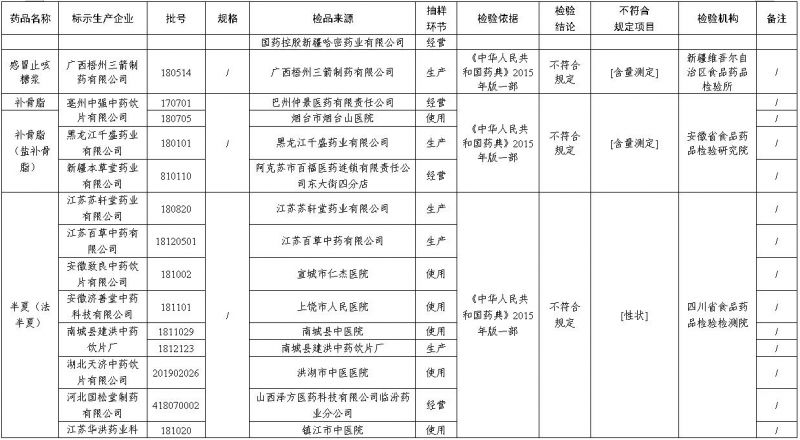
经安徽省食品药品检验研究院检验,标示为亳州中强中药饮片有限公司生产的1批次补骨脂不符合规定,标示为亳州中强中药饮片有限公司、黑龙江千盛药业有限公司、新疆本草堂药业有限公司生产的3批次补骨脂(盐补骨脂)不符合规定,不符合规定项目为含量测定。
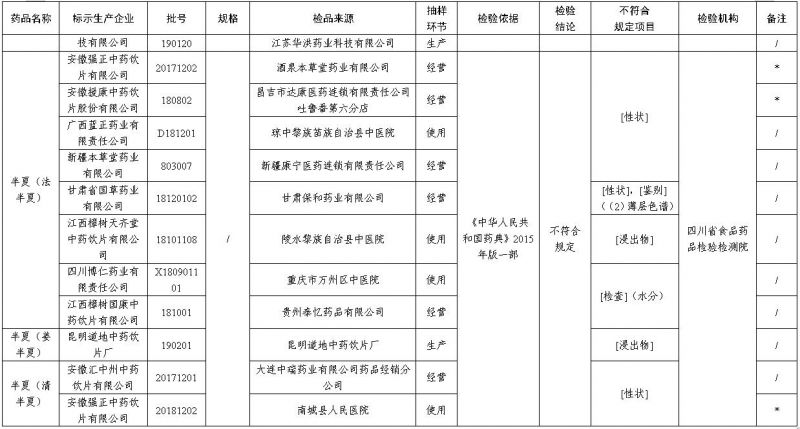
经四川省食品药品检验检测院检验,标示为江苏苏轩堂药业有限公司、江苏百草中药有限公司、安徽致良中药饮片有限公司、安徽济善堂中药科技有限公司、南城县建洪中药饮片厂、湖北天济中药饮片有限公司、河北国松堂制药有限公司、江苏华洪药业科技有限公司、广西蓝正药业有限责任公司、新疆本草堂药业有限公司、甘肃省国草药业有限公司、江西樟树天齐堂中药饮片有限公司、四川博仁药业有限责任公司、江西樟树国康中药饮片有限公司等企业生产的18批次半夏(法半夏)不符合规定,标示为昆明道地中药饮片厂生产的1批次半夏(姜半夏)不符合规定,标示为安徽汇中州中药饮片有限公司等企业生产的2批次半夏(清半夏)不符合规定,不符合规定项目包括性状、鉴别、浸出物、水分。
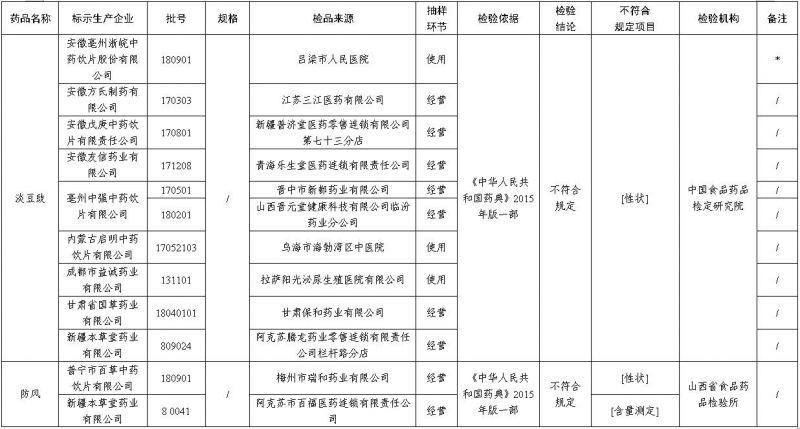
经中国食品药品检定研究院检验,标示为安徽方氏制药有限公司、安徽戊庚中药饮片有限责任公司、安徽友信药业有限公司、亳州中强中药饮片有限公司、内蒙古启明中药饮片有限公司、成都市益诚药业有限公司、甘肃省国草药业有限公司、新疆本草堂药业有限公司等企业生产的10批次淡豆豉不符合规定,不符合规定项目为性状。
经山西省食品药品检验所检验,标示为普宁市百草中药饮片有限公司、新疆本草堂药业有限公司生产的2批次防风不符合规定,不符合规定项目包括性状、含量测定。
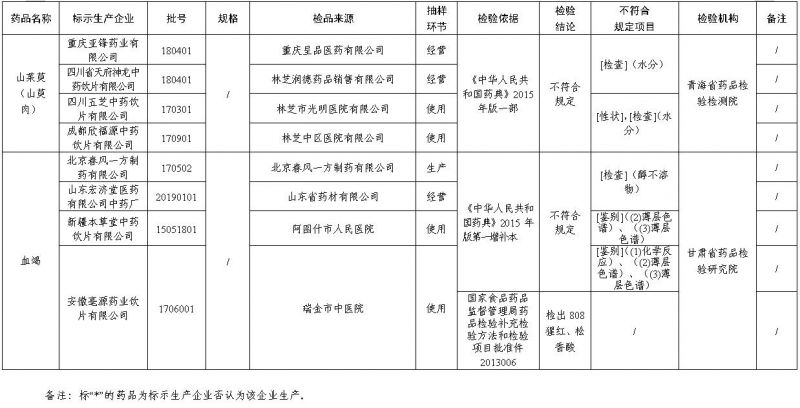
经青海省药品检验检测院检验,标示为重庆亚锋药业有限公司、四川省天府神龙中药饮片有限公司、四川五芝中药饮片有限公司、成都欣福源中药饮片有限公司生产的4批次山茱萸(山萸肉)不符合规定,不符合规定项目包括性状、水分。
经甘肃省药品检验研究院检验,标示为北京春风一方制药有限公司、山东宏济堂医药有限公司中药厂、新疆本草堂中药饮片有限公司、安徽亳源药业饮片有限公司生产的4批次血竭不符合规定,不符合规定项目包括鉴别、醇不溶物;其中标示为安徽亳源药业饮片有限公司生产的1批次血竭同时检查出808猩红、松香酸(详见附件)。
二、对上述不符合规定药品,药品监督管理部门已要求相关企业和单位采取暂停销售使用、召回等风险控制措施,对不符合规定原因开展调查并切实进行整改。
三、国家药品监督管理局要求相关省级药品监督管理部门依据《中华人民共和国药品管理法》组织对上述企业和单位生产销售假劣药品的违法行为立案调查,自收到检验报告书之日起3个月内,完成对相关企业或单位的调查处理并公开结果。
在立案调查工作中,企业对产品真实性有异议的,可以向所在地省级药品监督管理部门提出。标示生产企业所在地省级药品监督管理部门应对该企业的生产销售情况进行调查核实,被抽样单位所在地省级药品监督管理部门应追溯问题产品来源;两地药品监督管理部门要相互配合、及时通报、一查到底,并将相关工作情况按要求及时上报。
特此通告。
国家药监局
2019年11月20日
附件:57批次不符合规定药品名单
中国医药新闻网责任编辑:荃鹏 |







































